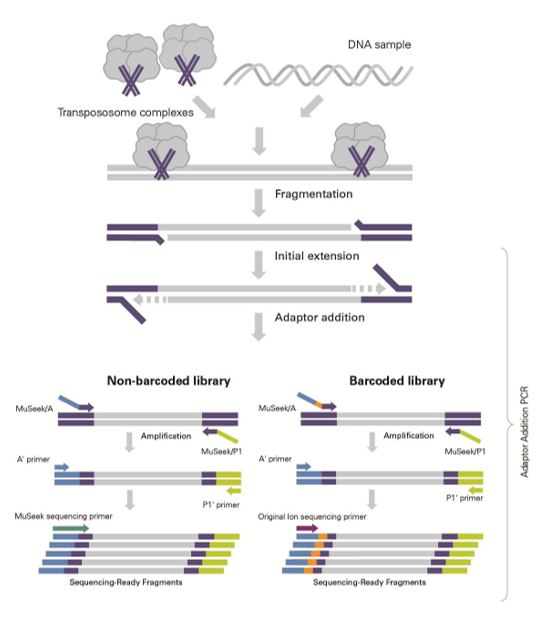
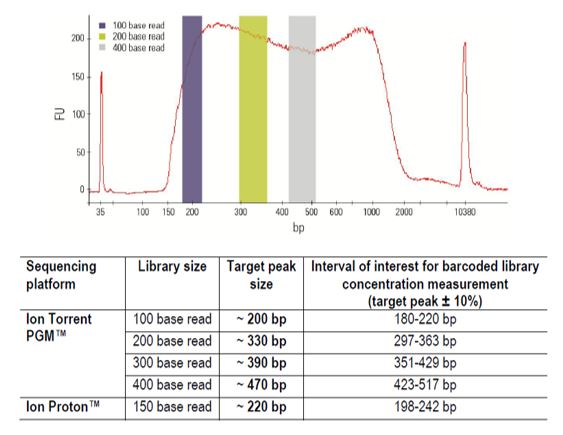
Thermo Scientific MuSeek Library™ Preparation Kit pro Ion Torrent™ je určen pro konstrukci vysoce kvalitních genomových DNA knihoven pro sekvenování na systémech Ion Personal Genome Machine™ (PGM™) a Ion Proton™. Rychlý protokol využívá enzym MuA transpozázu, která katalyzuje současně fragmentaci cílové dvouřetězcové DNA a označení konců fragmentů transpozónovou DNA. V následném kroku PCR jsou adaptéry specifické pro danou platformu přidány pomocí robustní a přesné Thermo Scientific Phusion™ High-Fidelity DNA polymerázy. Stejný protokol může být použit pro konstrukci knihovny s 100-400bp inserty při použití pouze 100ng výchozího vzorku.
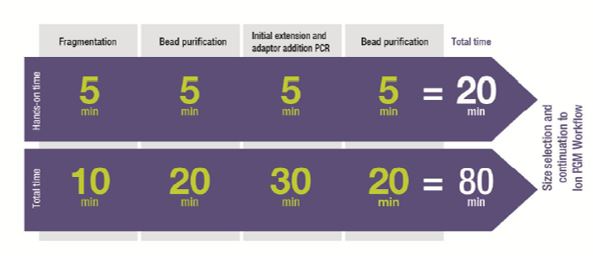
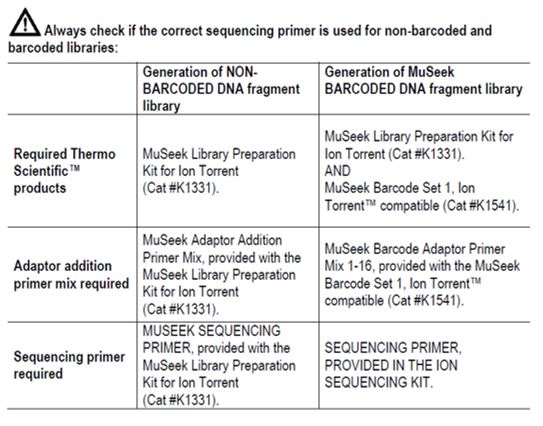
Kit obsahuje reagencie dostatečné pro 10 fragmentací a následných PCR reakcí. Kit obsahuje také MuA specifický sekvenační primer, který je potřeba pro PGM sekvenování, když jsou touto metodou připraveny knihovny bez čárového kódu.Schéma pracovního postupu: